Правило Гунда
При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных p-орбиталях:
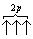
В этом случае суммарный спин равен 3/2 , поскольку его проекция равна ms = +1/2-1/2+1/2=1/2 . Эти же три электрона не могут быть расположены таким образом:
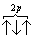
потому что тогда проекция суммарного спина ms = +1/2-1/2+1/2=1/2 . По этой же причине именно так, как приведено выше, расположены электроны в атомах углерода, азота и кислорода.
Рассмотрим далее электронные конфигурации атомов следующего третьего периода. Начиная с натрия 11Nа, заполняется третий энергетический уровень с главным квантовым числом n = 3. Атомы первых восьми элементов третьего периода обладают следующими электронными конфигурациями:
