Номенклатура
Названия первых десяти членов ряда предельных углеводородов уже даны. Чтобы подчеркнуть, что алкан имеет неразветвленную углеродную цепь, часто к названию добавляют слово нормальный (н-), например:
СН3—СН2—СН2—СН3 СН3—СН2—СН2—СН2—СН2—СH 2 —СН3
н-бутан н-гептан
(нормальный бутан) (нормальный гептан)
При отрыве атома водорода от молекулы алкана образуются одновалетные частицы, называемые углеводородными радикалами (сокращенно обозначаются буквой R). Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания –ан на -ил. Вот соответствующие примеры:
|
Углеводороды |
|||
|
Метан |
CH 4 |
Гексан |
C 6 H 14 |
|
Этан |
C 2 H 6 |
Гептан |
C 7 H 16 |
|
Пропан |
C 3 H 8 |
Октан |
C 8 H 18 |
|
Бутан |
C 4 H 10 |
Нонан |
C 9 H 20 |
|
Пентан |
C 5 H 12 |
Декан |
C 10 H 22 |
|
Одновалентные радикалы |
|||
|
Метил |
CH 3 — |
Гексил |
C 6 H 13 — |
|
Этил |
C 2 H 5 — |
Гептил |
C 7 H 15 — |
|
Пропил |
C 3 H 7 — |
Октил |
C 8 H 17 — |
|
Бутил |
C 4 H 9 — |
Нонил |
C 9 H 19 — |
|
Пентил (амил) |
C 5 H 11 — |
Децил |
C 10 H 21 — |
Радикалы образуются не только органическими, но и неорганическими соединениями. Так, если от азотной кислоты отнять гидроксильную группу ОН, то получится одновалентный радикал — NO2 , называемый нитрогруппой, и т. д.
При отнятии от молекулы углеводорода двух атомов водорода получаются двухвалентные радикалы. Их названия также производятся от названий соответствующих предельных углеводородов с заменой окончания -ан на -илиден (если атомы водорода оторваны от одного атома углерода) или -илен (если атомы водорода оторваны от двух соседних атомов углерода). Радикал СН2= имеет название метилен.
Названия радикалов используются в номенклатуре многих производных углеводородов. Например: СН3I — йодистый метил, С4Н9Сl -хлористый бутил, СН 2Сl 2 — хлористый метилен, С2Н4Вr 2 — бромистый этилен (если атомы брома связаны с разными атомами углерода) или бромистый этилиден (если атомы брома связаны с одним атомом углерода).
Для названия изомеров широко применяют две номенклатуры: старую — рациональную и современную — заместительную, которую также называют систематической или международной (предложена Международным союзом теоретической и прикладной химии ИЮПАК).
По рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы. Если в формуле одинаковые радикалы повторяются несколько раз, то их указывают греческими числительными: ди — два, три — три, тетра — четыре, пента — пять, гекса — шесть и т. д. Например:
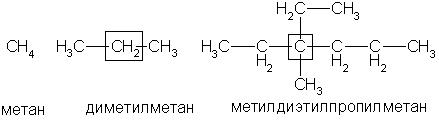
Рациональная номенклатура удобна для не очень сложных соединений.
По заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители. В этом случае выбирают наиболее длинную цепь углеродных атомов и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал (начиная с простейшего радикала); 2) углеводород, которому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми. Вот как по этой номенклатуре следует назвать изомеры гексана:
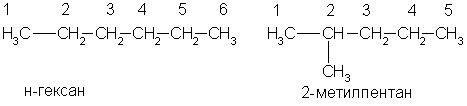
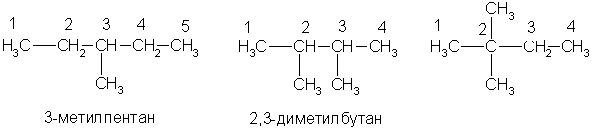
А вот более сложный пример:
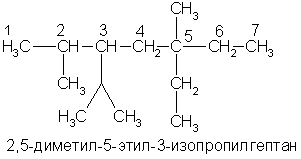
Как заместительная, так и рациональная номенклатура применяются не только для углеводородов, но и для других классов органических соединений. Для некоторых органических соединений используются исторически сложившиеся (эмпирические) или так называемые тривиальные названия (муравьиная кислота, серный эфир, мочевина и др.).
При написании формул изомеров легко заметить, что атомы углерода занимают в них неодинаковое положение. Атом углерода, который связан только с одним атомом углерода в цепи, называется первичным, с двумя — вторичным, с тремя — третичным, с четырьмя — четвертичным. Так, например, в последнем примере атомы углерода 1 и 7 — первичные, 4 и 6 — вторичные, 2 и 3 — третичные, 5 — четвертичный. Свойства атомов водорода, других атомов и функциональных групп зависят от того, с каким углеродным атомом они связаны: с первичным, вторичным или третичным. Это всегда надо учитывать.
