Составление уравнений окислительно-восстановительных реакций
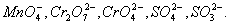
Как показывает само название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса: Н2S → S + 2H+ Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства: Н2S — 2е— = S + 2H+ Это первая полуреакция — процесс окисления восстановителя Н2S. Обесцвечивание раствора связано с переходом иона MnO4— (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой MnO4— → Mn2+ В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так: MnO4— + 8Н+→ Мn2+ + 4Н2О Чтобы стрелку заменить на знак равенства,…
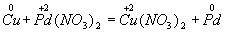
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах. Пример 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления: Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь — восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции: Cu + Pd(NO3)2 = Cu(NO3)2…
