Необратимые и обратимые реакции
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
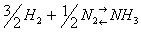 ,
,
∆H = -46,2 кДж / моль
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции — выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
