Разновидности ковалентной связи. Механизм образования
Различают две разновидности ковалентной связи: неполярную и полярную.
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н2, Сl2, О2, N2, F2 и др., в которых электронная пара в одинаковой мере принадлежит обоим атомам.
В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: НСl, Н2О, Н2S, NН3 и др.
Образование молекулы НСl можно представить схемой
Н.+ .Сl: = Н :Cl:
Электронная пара смещена к атому хлора, так как относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1).
Ковалентная связь образуется не только за счет перекрывания одноэлектронных облаков, — это обменный механизм образования ковалентной связи.
Возможен и другой механизм ее образования — донорно-акцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония 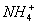 .
.
В молекуле аммиака атом азота имеет неподеленную пару электронов двухэлектронное облако):
 . . |
У иона водорода свободна (не заполнена) 1s-орбиталь, что можно обозначить как □H+. При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, т.е. оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой
 |
+ □H+ → |  |
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащее азоту, становится общим с водородом. В схемах изображение ячейки □ часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т.е. предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертая N—Н-связь в ионе аммония ничем не отличается от остальных трех.
