Строение молекул

Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Учение о строении атомов объясняет механизм образования молекул, а также природу химической связи. У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Если число электронов на внешнем уровне атома максимальное, которое он может…
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода: Н + Н = Н2; ∆H = — 436 кДж/моль Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей) . В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако,…
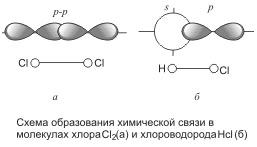
Разновидности ковалентной связи. Механизм образования

Различают две разновидности ковалентной связи: неполярную и полярную. В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н2, Сl2, О2, N2, F2 и др., в которых электронная пара в одинаковой мере принадлежит…
