Практическая химия
Алюминий — важнейший легкий металл

Поместим полоску листового алюминия или кусочек алюминиевой проволоки в несветящуюся часть пламени бунзеновской горелки. Металл покроется плотным слоем оксида алюминия Аl2О3. Чистый алюминий плавится при 658 °С, однако в данном случае этого не произойдет, так как он защищен пленкой оксида. Оксид алюминия плавится при 2700 °С в кислородно-водородной горелке или в электрической дуге. Переплавленный оксид…
Выплавка меди и свинца в лабораторном тигле

Самым простым и дешевым восстановителем оксидных руд является углерод. Раньше для металлургической переработки оксидов применяли древесный уголь, а теперь — кокс. Углерод может восстановить оксиды многих металлов, но для проведения реакции чаще всего требуется высокая температура. Для получения меди и свинца необходима температура яркого красного каления. Чтобы можно было нагреть до нужного состояния маленький фарфоровый…
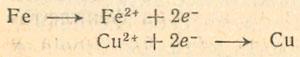
Чтобы сформулировать закономерности протекающих процессов, мы можем ограничиться рассмотрением катионов, а анионы исключить, так как они сами в реакции не участвуют. (Правда, на скорость осаждения влияет вид анионов.) Если для простоты предположить, что и выделяющийся и растворенный металлы двухвалентные, то можно записать: причем для первого опыта Me1 = Fe, Me2 = Сu. Итак, процесс состоит…

По экспериментальной химии металлов и их соединений можно было бы написать объемистую книгу. До сих пор, изучая с помощью несложных опытов некоторые свойства металлов и их солей, мы в лучшем случае могли сделать многосторонний, но несистематический и далеко не полный обзор. Теперь уделим особенное внимание распределению металлов по группам и важнейшим свойствам этих групп. Далее…
Щелочные металлы (главная подгруппа I группы)

Щелочные металлы химически очень активны и бурно реагируют с водой, в результате чего образуются сильные основания. С солями щелочных металлов калия и натрия мы уже познакомились. Аналитически обнаружить эти металлы сложно, так как они не образуют нерастворимых солей при взаимодействии с наиболее употребимыми кислотами, поэтому реакции осаждения возможны лишь со сложными реагентами. Не известны также…

В несветящемся пламени бунзеновской горелки будем держать палочки магнезии до тех пор, пока не исчезнет начальная окраска пламени. Затем нанесем на палочку чуть-чуть поваренной соли и опять поместим ее в пламя, которое окрасится в яркий желтый цвет. Так как окраска очень интенсивна, а натрий является почти непременной примесью в солях, всегда следует убедиться, сравнивая полученную…
Металлы побочной подгруппы I группы

В противоположность щелочным металлам, медь, серебро и золото очень инертны. Они обладают незначительным сродством к кислороду, их оксиды очень легко восстанавливать и металлы встречаются в природе в элементарной форме (золото чаще всего). Благородный характер металлов усиливается от меди к серебру, а от него — к золоту. Для остальных побочных групп периодической системы также существует правило,…
Окисление и восстановление меди

В несветящееся пламя бунзеновской горелки внесем пинцетом кусочек медной проволоки. Медь начнет интенсивно окисляться: сначала на поверхности появятся цвета побежалости, затем медь окрасится в черный цвет, так как образуется слой оксида меди (П) СuО. При обычной температуре очень быстро возникает слой красного оксида меди (I) CuО, который постоянно существует на поверхности. Если внести окисленную медь…

Почти все важнейшие части орудий производства, начиная простейших механизмов и кончая сложными машинами, изготовлены из металлов. Хотя широко используемые в последнее время пластмассы частично заменяют металлы, производство металлов все время возрастает, и в будущем все равно главным образом из них будут изготовлять большинство промышленных установок, машины, моторы, электрическую проводку, котлы высокого давления и т. д….
Лёйна задохнулась бы без азота

Если бы в начале нашего века учитель географии в немецкой гимназии спросил своего ученика о Лёйне, то он едва ли получил бы удовлетворительный ответ. В то время Лёйна была деревней а государственном округе Мерзебург и насчитывала около трехсот жителей. В географической книге 1899 г. говорится, что там расположены залежи бурого угля, который может быть использован…
