Заглянем за кулисы
Чтобы сформулировать закономерности протекающих процессов, мы можем ограничиться рассмотрением катионов, а анионы исключить, так как они сами в реакции не участвуют. (Правда, на скорость осаждения влияет вид анионов.) Если для простоты предположить, что и выделяющийся и растворенный металлы двухвалентные, то можно записать:

причем для первого опыта Me1 = Fe, Me2 = Сu. Итак, процесс состоит в обмене зарядами (электронами) между атомами и ионами обоих металлов. Если отдельно рассматривать (в качестве промежуточных реакций) растворение железа или осаждение меди, то получим:
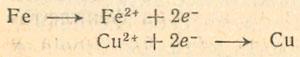
Теперь рассмотрим случай, когда металл погружен в воду или в раствор соли, с катионом которой обмен невозможен из-за его положения в ряду напряжений. Несмотря на это, металл стремится перейти в раствор в виде иона. При этом атом металла отдает два электрона (если металл двухвалентный), поверхность погруженного в раствор металла заряжается по отношению к раствору отрицательно, а на границе раздела образуется двойной электрический слой. Эта разность потенциалов препятствует дальнейшему растворению металла, так что процесс вскоре приостанавливается. Если в раствор погрузить два различных металла, то они оба зарядятся, но менее активный — несколько слабее, в силу того, что его атомы менее склонны к отщеплению электронов. Соединим оба металла проводником. Вследствие разности потенциалов поток электронов потечет от более активного металла к менее активному, который образует положительный полюс элемента. Протекает процесс, при котором более активный металл переходит в раствор, а катионы из раствора выделяются на более благородном металле.
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
- Металлы главной подгруппы III группы
- Обжиг руды
- Металлические покрытия, «деревья» и «ледяные узоры» без тока
- Алюминий — важнейший легкий металл
- Выплавка меди и свинца в лабораторном тигле
- Сущность гальванического элемента
- Группа углерода (главная подгруппа IV группы)
- Восстановление оксида меди
- Нанесение гальванических покрытий
- Олово — необходимый, но редкий элемент
