Сущность гальванического элемента
Проиллюстрируем теперь несколькими опытами приведенные выше несколько абстрактные рассуждения (которые к тому же представляют собой грубое упрощение).
Сначала наполним химический стакан вместимостью 250 мл до середины 10 %-ным раствором серной кислоты и погрузим в нее не слишком маленькие куски цинка и меди. К обоим электродам припаяем или приклепаем медную проволоку, концы которой не должны касаться раствора.
Пока концы проволоки не соединены друг с другом, мы будем наблюдать растворение цинка, которое сопровождается выделением водорода. Цинк, как следует из ряда напряжения, активнее водорода, поэтому металл может вытеснять водород из ионного состояния. На обоих металлах образуется двойной электрический слой. Разность потенциалов между электродами проще всего обнаружить с помощью вольтметра. Непосредственно после включения прибора в цепь стрелка укажет примерно 1 В, по затем напряжение быстро упадет. Если подсоединить к элементу маленькую лампочку, потребляющую напряжение 1 В, то она загорится — сначала довольно сильно, а затем накал станет слабым.
По полярности клемм прибора можно сделать вывод, что медный электрод является положительным полюсом. Это можно доказать и без прибора, рассмотрев электрохимию процесса. Приготовим в маленьком химическом стакане или в пробирке насыщенный раствор поваренной соли, добавим примерно 0,5 мл спиртового раствора индикатора фенолфталеина и погрузим оба замкнутых проволокой электрода в раствор. Около отрицательного полюса будет наблюдаться слабое красноватое окрашивание, которое вызвано образованием на катоде гидроксида натрия.
В других опытах можно помещать в ячейку различные пары металлов и определять возникающее напряжение. Например, магний и серебро дадут особенно большую разность потенциалов благодаря значительному расстоянию между ними в ряду напряжений, а цинк и железо, наоборот, очень маленькую, менее десятой доли вольта. Применяя алюминий, мы не получим из-за пассивации практически никакого тока.
Все эти элементы, или, как говорят электрохимики, цепи, имеют тот недостаток, что при съеме тока на них очень быстро падает напряжение. Поэтому электрохимики всегда измеряют истинную величину напряжения в обесточенном состоянии с помощью метода компенсации напряжения, то есть сравнивая его с напряжением другого источника тока.
Рассмотрим процессы в медно-цинковом элементе несколько подробнее. На катоде цинк переходит в раствор по следующему уравнению:
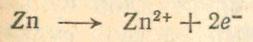
На медном аноде разряжаются ионы водорода серной кислоты. Они присоединяют электроны, поступающие по проволоке от цинкового катода и в результате образуются пузырьки водорода:
2H+ + 2e— → H2
Через короткий промежуток времени медь покроется тончайшим слоем пузырьков водорода. При этом медный электрод превратится в водородный, а разность потенциалов уменьшится. Этот процесс называют поляризацией электрода. Поляризацию медного электрода можно устранить, добавив в ячейку после падения напряжения немного раствора бихромата калия. После этого напряжение опять увеличится, так как бихромат калия окислит водород до воды. Бихромат калия действует в этом случае как деполяризатор.
На практике применяют гальванические цепи, электроды которых не поляризуются, или цепи, поляризацию которых можно устранить, добавив деполяризаторы.
В качестве примера неполяризуемого элемента рассмотрим элемент Даниэля, который раньше часто использовали как источник тока. Это тоже медно-цинковый элемент, но оба металла погружены в различные растворы. Цинковый электрод помещается в пористой глиняной ячейке, наполненной разбавленной (примерно 20 %-ной) серной кислотой. Глиняную ячейку подвешивают в большом стакане, в котором находится концентрированный раствор сульфата меди, а на дне — слой кристаллов сульфата меди. Вторым электродом в этом сосуде служит цилиндр из медного листа.
Этот элемент можно изготовить из стеклянной банки, имеющейся в продаже глиняной ячейки (в крайнем случае используем цветочный горшок, закрыв отверстие в дне) и двух подходящих по размеру электродов.
В процессе работы элемента цинк растворяется с образованием сульфата цинка, а на медном электроде выделяются ионы меди. Но при этом медный электрод не поляризуется и элемент дает напряжение около 1 В. Собственно, теоретически напряжение на клеммах составляет 1,10 В, но при съеме тока мы измеряем несколько меньшую величину, вследствие электрического сопротивления ячейки.
Если мы не снимем ток с элемента, нужно вытащить цинковый электрод из раствора серной кислоты, потому что иначе он будет растворяться с образованием водорода.
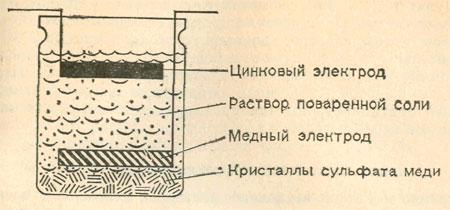
Схема простой ячейки, для которой не требуется пористой перегородки, показана на рисунке. Цинковый электрод расположен в стеклянной банке наверху, а медный — вблизи дна. Вся ячейка наполнена насыщенным раствором поваренной соли. На дно банки насыплем горсть кристаллов сульфата меди. Образующийся концентрированный раствор сульфата меди будет смешиваться с раствором поваренной соли очень медленно. Поэтому при работе элемента на медном электроде будет выделяться медь, а в верхней части ячейки будет растворяться цинк в виде сульфата или хлорида.
Сейчас для батарей используют почти исключительно сухие элементы, которые более удобны в употреблении. Их родоначальником является элемент Лекланше. Электродами служат цинковый цилиндр и угольный стержень. Электролит представляет собой пасту, которая в основном состоит из хлорида аммония. Цинк растворяется в пасте, а на угле выделяется водород. Чтобы избежать поляризации, угольный стержень опускают в полотняный мешочек со смесью из угольного порошка и пиролюзита. Угольный порошок увеличивает поверхность электрода, а пиролюзит действует как деполяризатор, медленно окисляя водород. Правда, деполяризующая способность пиролюзита слабее, чем у упоминавшегося ранее бихромата калия. Поэтому при получении тока в сухих элементах напряжение быстро падает, они «утомляются» вследствие поляризации. Только через некоторое время происходит окисление водорода пиролюзитом. Таким образом, элементы «отдыхают», если некоторое время не пропускать ток.
Проверим это на батарейке для карманного фонарика, к которой подсоединим лампочку. Параллельно лампе, то есть непосредственно на клеммы, подключим вольтметр. Сначала напряжение составит около 4,5 В. (Чаще всего в таких батарейках последовательно включены три ячейки, каждая с теоретическим напряжением 1,48 В.) Через некоторое время напряжение упадет, накал лампочки ослабеет. По показаниям вольтметра мы сможем судить, как долго батарейке нужно отдыхать.
Особое место занимают регенерирующие элементы, известные под названием аккумуляторы. В них протекают обратимые реакции, и их можно перезаряжать после разрядки элемента, подключив к внешнему источнику постоянного тока.
В настоящее время наиболее распространены свинцовые аккумуляторы; в них электролитом служит разбавленная серная кислота, куда погружены две свинцовые пластины. Положительный электрод покрыт пероксидом свинца РbО2, отрицательный представляет собой металлический свинец. Напряжение на клеммах составляет примерно 2,1 В. При разрядке па обеих пластинах образуется сульфат свинца, который опять превращается при зарядке в металлический свинец и в пероксид свинца.
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
- Опыты с серебром
- Металлы побочной подгруппы VII группы
- Железо и никель в необычной форме
- Основной процесс фотографии
- Железо — самый употребительный металл
- Получим железную пыль
- Пробирное искусство
- Кобальт — компонент магнита
- Никель по тому же рецепту
- Щелочноземельные металлы (главная подгруппа II группы)
