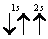Принцип Паули
В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так:
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Хотя бы одно из квантовых чисел n, l, ml и ms, должно обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2 другой c ms = -1/2 . Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml.
Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml=0 и ms может иметь произвольные значения: +1/2 или -1/2 . Мы видим, что если n = 1, таких электронов может быть только два.
В общем случае, при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l, принимающим значения от 0 до n 1. При заданных n и l может быть (2l + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l и ml соответствуют два разных значения проекции спина ms.
Следовательно, максимальное число электронов с одинаковым квантовым числом n выражается суммой
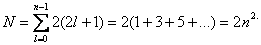
Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т.д.
Рассмотрим, например, атом гелия. В атоме гелия 2He квантовые числа n = 1, l = 0 и ml = 0 одинаковы для обоих его электронов, а квантовое число ms отличается. Проекции спина электронов гелия могут быть ms = +1/2 или ms = -1/2 . Строение электронной оболочки атома гелия 2Не можно представить как 1s2 или, что то же самое
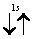
Заметим, что в одной квантовой ячейке согласно принципу Паули никогда не может быть двух электронов с параллельными спинами.
Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1s, а только в состоянии 2s: