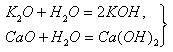Получение. Свойства
Основные оксиды. К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов:
1. Окисление металлов при нагревании в атмосфере кислорода:
2Mg + О2 = 2МgО,
2Сu + О2 = 2СuО.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2О, К2О крайне труднодоступны.
2. Обжиг сульфидов:
2CuS + ЗО2 = 2СuО + 2SО2,
4FeS2 + 11О2 = 2Fе2О3 + 8SО2.
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
3. Разложение гидроксидов:
| to | ||
| Cu(OH)2 | = | CuO + H2O |
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот:
| to | ||
| BaCO3 | = | BaO + CO2 |
| to | ||
| 2Рb(NО3)2 | = | 2PbО + 4NO2+O2 |
| to | ||
| 4FеSО4 | = |
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
| to | ||
| [ZnOH]2 | = |
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О2—, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
| to | ||
| 2HgO | = |
| to | ||
| 2Ag2O | = |
Основные оксиды при нагревании могут вступать в реакции кислотными и амфотерными оксидами, с кислотами:
ВаО + SiO2 = ВаSiO3,
МgО + Аl2О3 = Мg(AlO2)2,
ZnО + Н2SО4 = ZnSО4 + Н2О.
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
| to | ||
| Fe2O3+2Al | = |
| to | ||
| 3CuO+2NH3 | = |
| to | ||
| 4FeO+O2 | = |
Кислотные оксиды. Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
| to | ||
| 4P+5O2 | = |
| to | ||
| 2ZnS+3O2 | = |
| to | ||
| K2Cr2O7+H2SO4 | = |
| Nа2SiO3 + 2НСl | = | 2NаСl + SiO2↓ + Н2О |
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
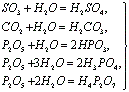
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, с щелочами:
| to | ||
| P2O5+Al2O3 | = |
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
| to | ||
| CO2+C | = |
| 2SO2+O2 | to | |
SО2 + 2Н2S = 3S + 2Н2О,
4CrO3 + С2Н5ОН = 2Сr2О3 + 2СО2 + ЗН2О.
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Аl2О3 + 6НСl = 2АlСl3 + ЗН2О,
Аl2О3 + 2NаОН + ЗН2О = 2Nа[Аl(ОН)4].
К числу амфотерных оксидов относятся оксид алюминия Аl2О3, оксид хрома (III) Сr2О3, оксид бериллия ВеО, оксид цинка ZnО, оксид железа (III) Fe2О3 и ряд других.
Идеально амфотерным оксидом является вода Н2О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
Сu2+ + Н2О ![]() Сu(ОН)+ + Н+,
Сu(ОН)+ + Н+,
СО32- + Н2О ![]() НСО3— + ОН—.
НСО3— + ОН—.