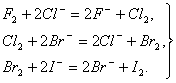Химические свойства
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Аl + 3F2 = 2АlF3 + 2989 кДж,
2Fе + 3F2 = 2FеF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
Н2 + F2 = 2НF + 547 кДж,
Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НаlF
где Наl = Сl, Вr, I, причем в соединениях НаlF степени окисления хлора, брома и иода равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Хе + F2 = ХеF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
3F2 + ЗН2О = F2О↑ + 4НF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Аl + ЗСl2 = 2АlСl3(кр) + 1405 кДж,
2Fе + ЗСl2 = 2АlСl3(кр) + 804 кДж,
Si + 2Сl2 = SiCl4(Ж) + 662 кДж,
Н2 + Сl2 = 2НСl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hv → 2Сl,
Сl + Н2 → НСl + Н,
Н + Cl2 → НСl + Сl,
Сl + Н2 → НCl + Н и т.д.
Возбуждение этой реакции происходит под действием фотонов (hv), которые вызывают диссоциацию молекул Сl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Сl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внес русский ученый, лауреат Нобелевской премии (1956 г) Н.Н. Семенов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
СН3-СН3 + Сl2 → СН3-СН2Сl + НСl,
СН2=СН2 + Сl2 → СН2Cl — СН2Сl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
Сl2 + 2НВr = 2НСl + Вr2,
Сl2 + 2НI = 2НСl + I2,
Сl2 + 2КВr = 2КСl + Вr2,
а также обратимо реагирует с водой:
Сl2 + Н2О ![]() НСl + НСlO — 25 кДж.
НСl + НСlO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала -1 (в НСl), у других +1 (в хлорноватистой кислоте НОСl). Такая реакция — пример реакции самоокисления—самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) с щелочами:
Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде),
ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si +2Вr2 = SiBr4(ж) + 433 кДж,
Н2 + Вr2 = 2НВr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 ![]() 2НI — 53 кДж.
2НI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в ряду F — I может вытеснять последующий из его соединений с водородом или металлами, т.е. каждый галоген в виде простого вещества способен окислять галогенид—ион любого из последующих галогенов: