Практическая химия
Поливинилхлорид — важнейшая пластмасса
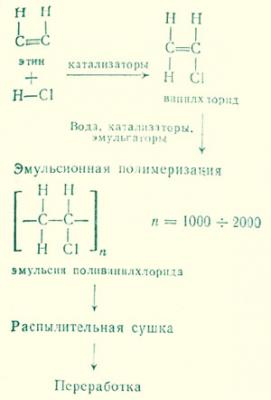
Месторождения цветных металлов на Земле, и раньше не такие уж богатые, быстро исчерпываются. Между тем, их потребление все время растет в связи с ростом машиностроения и вообще с развитием техники. Эту диспропорцию помогают устранить пластмассы. Слово поливинилхлорид в наши дни можно услышать очень часто. Например, во многих отраслях химической промышленности он вытеснил свинец. Из него…
Анилиновый черный — краситель для хлопка

Открытый в 1863 г. Анилиновый черный относится к числу старейших органических красителей. Это популярный краситель хиноидного строения, имеющий брутто-формулу C48H34N8. В пробирке к 0,5 мл анилина прильем равный объем концентрированной соляной кислоты, смесь взболтаем и медленно добавим 7 мл воды. Затем прильем к смеси еще 4 мл концентрированного раствора бихромата калия и оставим реакционную массу…
Препаративное получение сложного эфира

Один из сложных эфиров получим в достаточно чистом состоянии и в большем количестве. Выберем для этого метилсалицилат — душистое вещество, придающее аромат маслу барвинка. Для этого нам понадобятся круглодонная колба на 50—100 мл, холодильник или заменяющее его самодельное приспособление для охлаждения, делительная воронка в качестве приемника, изогнутая стеклянная трубка, горелка и штатив с принадлежностями, а…

Нашей планете уже около 5 миллиардов лет. Вначале она, вероятно, была раскаленным газовым шаром. Позднее в результате конденсации газов возникли металлы, камень, а потом и вода. К этому времени лишь некоторые газы окружали Землю, образуя ее первоначальную атмосферу. Однако прошло несколько миллиардов лет, а планета все еще был мертва. Только около миллиарда лет назад из…
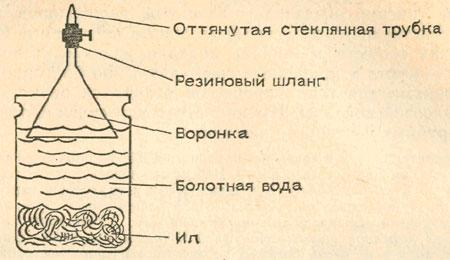
И сейчас в болотах гниют растения. Гниющий ил можно найти в стоячей воде пруда или вблизи от берега медленно текущего ручья. Происходящие при этом химические превращения подобны тем процессам, с которых начиналось образование угля и нефти. Проверим это с помощью опыта. Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»

Принесем из пруда немного ила. Можно взять вместо него и землю со дна болота. Вместе с илом или землей там же наберем воды. Этим илом заполним на одну треть большую стеклянную банку из-под консервов. После этого доверху нальем в банку болотной воды. Сверху укрепим стеклянную воронку, а к ней куском резинового шланга присоединим короткую стеклянную…
Основные понятия органической химии
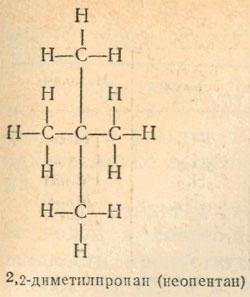
Углерод, конечно, нельзя отнести к числу наиболее распространенных химических элементов. В земной коре его всего лишь 0,12 %. Но от всех остальных элементов он отличается исключительным разнообразием химических соединений. Число известных в настоящее время соединений углерода более чем вдвое превышает количество соединений всех остальных элементов, вместе взятых. Такое своеобразие углерода объясняется особыми способностями его атомов…
Этен — ненасыщенный углеводород

В алканах все свободные валентности атомов углерода насыщены атомами водорода. Поэтому их называют еще насыщенными углеводородами. В отличие от них, ненасыщенные углеводороды содержат меньше водорода. Свободные валентности соседних атомов углерода взаимодействуют в них друг с другом и образуют двойные или тройные связи. В структурных формулах такие связи изображаются двумя или тремя черточками между соответствующими атомами…
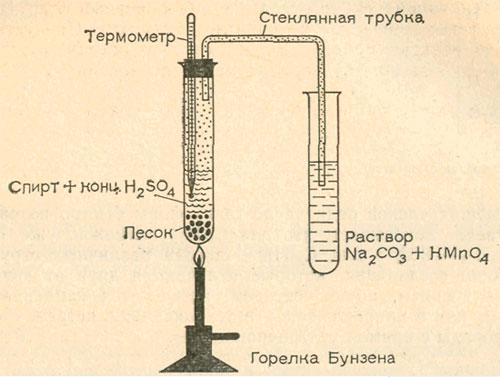
Соберем простой прибор. Для этого понадобятся две пробирки. К одной из них подберем пробку с двумя отверстиями и вставим в нее изогнутую стеклянную трубку и термометр со шкалой до 250 °С. Все соединения должны быть достаточно плотными, чтобы образующийся газ мог выходить только через трубку. В пробирку поместим 2 мл денатурированного спирта и осторожно, малыми…
Обнаружение элементов в органических веществах

Большинство органических соединений состоит преимущественно из углерода и водорода. Уже знакомые нам углеводороды содержат только эти два элемента. В остальных же органических соединениях, со многими из которых мы по¬знакомимся позже, содержатся еще один или несколько других элементов, чаще всего кислород, галогены (хлор, бром, иод), азот и сера. Приведенные ниже простые опыты во многих случаях пригодны…
