Получим азотную кислоту
С помощью каталитического окисления (метод Оствальда) можно перевести аммиак в азотную кислоту. На химическом комбинате Биттерфельд, смесь аммиака и воздуха с большой скоростью пропускают над платино-кобальтовым катализатором. Возникающий при этом бесцветный монооксид азота NO сначала превращается на воздухе в коричневый диоксид азота NO2, а затем при действии кислорода и воды — в азотную кислоту:
4NH3 + 5O2 → 4NO + 6 H2O
4NO + 2O2 → 4NO2
4NO2 + O2 +2H2O → 4HNO3
Мы же соберем установку, изображенную на рисунке.
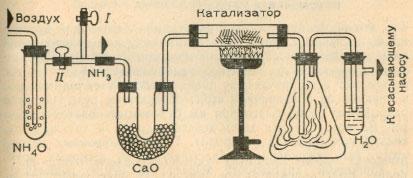
Для того, чтобы приготовить катализатор, добавим по каплям раствор хлорида железа (III) к раствору гидроксида аммония. При этом выпадает коричневый осадок гидроксида железа (Ш). Отфильтруем его, промоем на фильтре холодной водой, смешаем сырую еще массу с асбестом (можно отщипнуть волокна от подставки под утюг, использовать кусочек асбестового шнура и т. п.) и сильно прокалим массу. При этом на асбесте выделится оксид железа(Ш).
Пропустим сначала через установку поток воздуха (кран I открыт, кран II закрыт) с помощью водоструйного насоса (в крайнем случае достаточно применить для отсоса воздуха резиновый вентилятор) и сильно нагреем катализатор. Затем закроем кран I и откроем кран II.
Поток воздуха увлекает аммиак, который после сушки в U-образной трубке с негашеной известью СаО окисляется на катализаторе с образованием оксида азота. А он, взаимодействуя в конической колбе (так называемая колба Эрленмейера) с кислородом воздуха, превращается в диоксид. Наконец, в пробирке с боковой насадкой образуется азотная кислота. Хотя она очень разбавлена, мы можем обнаружить кислую среду с помощью лакмусовой бумажки, а наличие нитрат-ионов — как описано в разделе «Анализ минеральных удобрений».
Азотная кислота — бесцветная, очень едкая жидкость. Концентрированная кислота, 69,2 %-ная HNO3 с плотностью 1,41 г/м3, относительно легко отдает кислород. Поэтому она является сильным окислителем. Благодаря этому свойству она растворяет различные неактивные металлы, такие как медь, ртуть и серебро. Золото она не разрушает, поэтому можно отделить золото от серебра с помощью азотной кислоты. Однако смесь одной объемной части концентрированной азотной кислоты и трех объемных частей соляной кислоты — царская водка — растворяет и золото и платину.
Если мы хотим получить азотную кислоту более высокой концентрации, то смешаем в реторте 56 г сухой тонкораспыленной калийной селитры KNO3 с 32 мл концентрированной серной кислоты и перегоним получившуюся кислоту в хорошо охлаждаемый сборник.
Если реторта с тубусом, закроем его корковой пробкой, обернутой алюминиевой фольгой. Горло реторты опустим как можно глубже в сборник, который будем охлаждать в стакане с ледяной водой или в проточной водопроводной воде. Для этой цели поместим сборник в воронку и укрепим над ретортой шланг, в который подается холодная вода. Из воронки с помощью шланга отведем холодную воду в ведро или раковину. На окончание опыта укажет выделение коричневых ядовитых паров NO2:
2KNO3 + H2SO4 → K2SO4 + 2HNO3
Раньше азотную кислоту только таким методом и получали. Исходным продуктом служил встречающийся в Чили в больших количествах нитрат натрия NaNO3 (натриевая, или чилийская селитра).
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
