Горение сероводорода
Сделав предварительно пробу на гремучий газ, подожжем сероводород, выходящий из оттянутой на конце стеклянной трубки. Сероводород горит с появлением бледного пламени с голубым ореолом:
2H2S+3O2 → 2H2O + 2SO2↑
В результате сгорания возникает оксид серы (IV) или сернистый газ. Его легко определить по резкому запаху и по покраснению влажной голубой лакмусовой бумажки.
При недостаточном доступе кислорода сероводород окисляется только до серы. Активный уголь каталитически ускоряет этот процесс. Этим способом часто пользуются при тонкой очистке промышленных газов, содержание серы в которых не должно превышать 25 г/м3:
2H2S + O2 → 2H2O + 2S
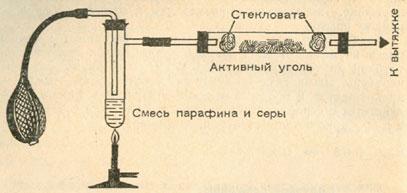
Нетрудно воспроизвести этот процесс. Схема установки изображена на рисунке. Главное заключается в том, чтобы пропустить через активный уголь воздух и сероводород в соотношении 1 : 3. На угле выделится желтая сера.
Активный уголь можно очистить от серы, промыв его в сероуглероде. В технике для этой цели применяют чаще всего раствор сульфида аммония (NН4)2S.
Два метода для одного продукта
Сера сгорает с появлением бледно-голубого пламени. При этом образуется бесцветный газ с резким запахом — оксид cepы (IV) SO2. Он ядовит и раздражает дыхательные пути, поэтому мы должны стараться не вдыхать его.
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
- Эксперименты с сернистой кислотой
- Хлориды щелочных металлов — сырье для получения оснований и кислот
- Камерный способ
- Как в Биттерфельде получают щелочи и кислоты
- Контактный способ
- Электрохимический комбинат на лабораторном столе
- Кислота из гипса
- Ртутный способ
- Получим ксилолит
- Диафрагма из выеденного яйца
