Кислота из гипса
Если сульфидов металлов мало (как, например, в ГДР), то исходными продуктами для получения серной кислоты могут служить ангидрит CaSO4 и гипс CaSO4*2H20. Метод получения оксида серы (IV) из этих продуктов был разработан Мюллером и Кюне еще 60 лет назад.
Способы получения серной кислоты из ангидрита будут иметь значение и в будущем, так как серная кислота является самым распространенным химическим продуктом. Установки для получения серной кислоты из гипса, производимые в ГДР, известны и ценятся на мировом рынке.
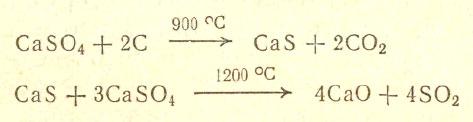
Сульфаты можно разложить, применяя высокую (до 2000 °С) температуру. Мюллер установил, что температуру разложения сульфата кальция можно снизить до 1200 °С, если добавить тонкоизмельченный кокс. Сначала, при 900 °С, кокс восстанавливает сульфат кальция до сульфида, а тот в свою очередь при температуре 1200 °С взаимодействует с неразложившимся сульфатом; при этом образуется оксид серы (IV) и негашеная известь:
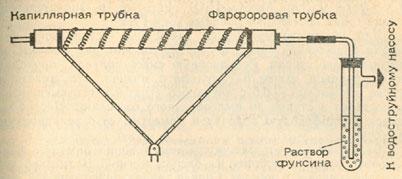
Разложить сульфат кальция в лабораторных условиях удастся только при применении соответствующей высокой температуры. Будем работать с аппаратурой, подобной той, какая была использована при обжиге пирита, только трубку для сгорания возьмем фарфоровую или железную. Закроем трубку пробками, обернутыми для теплоизоляции асбестовой тканью. В отверстие в первой пробке вставим капилляр, а во второй — простую стеклянную трубку, которую соединим с промывной склянкой, наполненной наполовину водой или раствором фуксина.
Реакционную смесь приготовим следующим образом. Растолчем в ступке 10 г гипса, 5 г каолина (продается в аптеке под названием «Bolus alba») и 1,5 г активного порошкообразного угля. Смесь высушим, нагревая некоторое время при 200 °С в фарфоровой чашке.
После охлаждения (лучше всего в эксикаторе) внесем смесь в середину трубки для сжигания. При этом обратим внимание на то, чтобы она не заполнила все поперечное сечение трубки. Затем сильно нагреем трубку с помощью двух горелок (одна снизу, вторая наклонно сверху) и, когда трубка накалится, пропустим через всю систему не слишком сильный поток воздуха. Уже через 10 минут, благодаря образованию сернистой кислоты, раствор фуксина в промывной склянке обесцветится. Выключим водоструйный насос и прекратим нагревание.
Получить высокую температуру мы можем также, если обмотаем как можно плотнее фарфоровую трубку нагревательной спиралью на 750—1000 Вт (см. рисунок). Концы спирали соединим с толстой медной проволокой, которую также многократно обмотаем вокруг трубки, а затем изолируем с помощью фарфоровых бусинок и подведем к штекеру. (Осторожно при работе с напряжением 220 В!) Естественно, в качестве источника нагрева может пригодиться также стеклодувная горелка или паяльная лампа.
В технике работают со смесью ангидрита, кокса, глины, песка и колчеданного огарка Fe2O3. Червячный транспортер подает смесь в 70-метровую вращающуюся трубчатую печь, где сжигают пылевидный уголь. Температура в концевой части печи, в месте горения, составляет примерно 1400 °С. При этой температуре образующаяся в ходе реакции негашеная известь сплавляется с глиной, песком и колчеданным огарком, в результате получается цементный клинкер. Остывший клинкер размалывают и смешивают с несколькими процентами гипса.
Получившийся в результате высококачественный портландцемент поступает в продажу. При тщательном проведении и контроле процесса из 100 т ангидрита (плюс глина, песок, кокс и колчеданный огарок) можно получить около 72 т серной кислоты и 62 т цементного клинкера.
Серную кислоту можно получать также из кизерита (сульфата магния MgSO*H2O), который в значительных количествах поставляют соляные копи ГДР.
Для опыта воспользуемся такой же установкой, как и для разложения гипса, но трубку на этот раз возьмем из тугоплавкого стекла. Реакционную смесь получим, прокалив в фарфоровой чашке 5 г сульфата магния, а в железном тигле с крышкой — 0,5 г активного угля, и затем смешав их и растерев в ступке до пылеобразного состояния. Перенесем смесь в фарфоровую лодочку и поместим ее в реакционную трубку.
Белая масса, которая получится в конце опыта в фарфоровой лодочке, состоит из оксида магния. В технике его перерабатывают в цемент Сореля, являющийся основой для производства ксилолита.
Получение таких важных для строительной промышленности производных продуктов, как цементный клинкер и ксилолит, делает производство серной кислоты из местного сырья особенно экономичным. Переработка промежуточных и побочных продуктов в ценное сырье или конечные продукты является важным принципом химической промышленности.
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
