Неорганическая химия
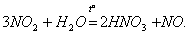
В оксидах степень окисления азота меняется от +1 до +5. Оксиды N2О и NO — бесцветные газы, оксид азот (IV) NO2 — бурый газ, получивший в промышленности название «лисий хвост». Оксид азота (III) N2О3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы. Часто используется тривиальное название оксида азота (I)…

Фосфорный ангидрид Р2О5 («простейшая» формула) является наиболее стабильным оксидом фосфора при обычных условиях. Это — твердое белое вещество состава Р4О10. Фосфористый ангидрид описывается простейшей формулой Р2O3 и истинной формулой Р4О6. Показано, что фосфор в Р4О6 координационно ненасыщен, и поэтому является неустойчивым. Взаимодействие Р4О6 с горячей водой приводит к диспропорционированию Р4О6 + 6Н2О = РН3↑ + ЗН3РО4; Газообразный НСl разлагает Р4О6: Р4О6 + 6НСl = 2Н3РО3 + 2РСl3. Р4О10 активно взаимодействует с водой, а также отнимает ее от других соединений, образуя в зависимости от условий, либо метафосфорную НРО3, либо ортофосфорную Н3РО4, либо пирофосфорную Н4Р2О7 кислоты. Именно поэтому Р4О10 широко используется как осушитель различных веществ от паров воды.

Азотная кислота HNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде. Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет: 4НNО3 = 4NО2 + 2Н2О + О2. Азотная кислота принадлежит к числу…
Место водорода в периодической системе

Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро атома окружено электронным облаком. Электронная конфигурация 1s1. В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон). Однако по свойствам он более сходен с галогенами, чем со щелочными металлами. Поэтому водород помещают в VII группу…

При нагревании твердых нитратов все они разлагаются с выделением кислорода (исключением является нитрат аммония), при этом их можно разделить на четыре группы. Первую группу составляют нитраты щелочных металлов, которые при нагревании разлагаются на нитриты и кислород: 2КNО3 = 2КNО2 + О2↑. Вторую группу составляет большинство нитратов (от щелочноземельных металлов до меди включительно), разлагающихся на оксид металла, NО2 и кислород: 2Сu(NО3)2 = 2СuО + 4NО2 + O2, Третью группу составляют нитраты наиболее тяжелых металлов (АgNО3 и Нg(NО3)2), разлагающиеся до свободного металла, NО2 и кислорода: Hg(NО3)2 = Нg + 2NО2 + О2, Четвертую «группу» составляет нитрат аммония: NН4NО3 = N2О + 2Н2O.
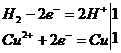
Физические свойства. Водород — это самый легкий газ (он в 14,4 раза легче воздуха), не имеет цвета, вкуса и запаха. Мало растворим в воде (в 1 л воды при 20°С растворяется 18 мл водорода). При температуре — 252,8°С и атмосферном давлении переходит в жидкое состояние. Жидкий водород бесцветен. Кроме водорода с массовым числом 1 существуют…
Азотистая кислота НNО2 принадлежит к слабым кислотам (К = 6.10-4 при 25 °С), неустойчива и известна лишь в разбавленных растворах, в которых осуществляется равновесие 2НNО2 NО + NО2 + Н2О. Нитриты в отличие от самой кислоты устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду.

В лабораторных условиях водород получают следующими способами. 1. Взаимодействием металла (цинка) с растворами соляной и серной кислот (реакция проводится в аппарате Киппа): Zn + 2Н+ = Zn2+ + Н2↑ 2. Электролизом воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н2SO4 или Na2SO4. На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода. В промышленности водород получают…

Из трех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота Н3РО4 (часто ее называют просто фосфорной) — белое твердое вещество, хорошо растворимое в воде. В водном растворе она диссоциирует ступенчато. Как трехосновная, фосфорная кислота образует три типа солей: дигидрофосфаты (NаН2РО4); гидрофосфаты (Nа2НРО4); фосфаты (Na3РО4). Все дигидрофосфаты растворимы в воде. Из гидрофосфатов и фосфатов в воде растворимы только соли щелочных металлов и аммония. Соли фосфорной кислоты являются ценными минеральными удобрениями. Наиболее распространенные среди них — суперфосфат, преципитат и фосфоритная мука. Простой суперфосфат — смесь дигидрофосфата кальция Са(Н2РО4)2 и «балласта» СаSО4. Его получают, обрабатывая фосфориты и апатиты серной кислотой. При обработке минеральных фосфатов фосфорной кислотой получают двойной суперфосфат Са(Н2РО4)2. При гашении фосфорной кислоты известью получают преципитат СаНРО4.2Н2О. Важное значение имеют сложные удобрения (т.е. содержащие одновременно азот и фосфор; или азот, фосфор и калий). Из них наиболее известен аммофос — смесь NН4Н2РО4 и (NН4)2НРО4.

Вода — наиболее распространенное соединение на Земле. Ее количество достигает 1018 т, и она покрывает приблизительно четыре пятых земной поверхности. Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды). Вода играет жизненно важную роль в промышленности, быту и в лабораторной практике; она совершенно необходима для поддержания жизни. Приблизительно две трети человеческого тела приходятся на долю воды, и многие пищевые продукты состоят преимущественно из воды. Содержание воды в некоторых пищевых продуктах Пищевые продукты Содержание воды, масс. % Помидоры Грибы Молоко Апельсины Яблоки Рыба Картофель Яйца Мясо (говядина) 95 92 87 86 84 82 76 75 64…
