Кислород
Кислород — второй по электроотрицательности элемент после фтора, поэтому он проявляет сильные окислительные свойства. С большинством металлов он реагирует уже при комнатной температуре, образуя основные оксиды. С неметаллами (за исключением гелия, неона, аргона) кислород реагирует, как правило, при нагревании. Так, с фосфором он реагирует при температуре ~ 60 °С, образуя Р2О5, с серой — при температуре около 250 °С: S + О2 = SO2. С графитом кислород реагирует при 700 °С С + О2 = СО2. Взаимодействие кислорода с азотом начинается лишь при 1200°С или в электрическом разряде N2 + О2 2NО — Q. Кислород реагирует и со многими сложными соединениями, например с оксидом азота (II) он реагирует уже при комнатной температуре: 2NО + О2…
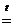
В промышленности кислород получают: 1) фракционной перегонкой жидкого воздуха (азот, обладающий более низкой температурой кипения, испаряется, а жидкий кислород остается); 2) электролизом воды. Ежегодно во всем мире получают свыше 80 млн. т кислорода. В лабораторных условиях кислород получают разложением ряда солей, оксидов и пероксидов: 2КМnО4 К2MnО4 + МnО2 + О2↑, 4К2Сr2О7 4К2CrO4 + 2Сr2О3 + 3O2↑, 2КNО3 2КNО2 + О2↑, 2Pb3О4 6PbО + О2↑,…
