Химия углерода

Принесем из пруда немного ила. Можно взять вместо него и землю со дна болота. Вместе с илом или землей там же наберем воды. Этим илом заполним на одну треть большую стеклянную банку из-под консервов. После этого доверху нальем в банку болотной воды. Сверху укрепим стеклянную воронку, а к ней куском резинового шланга присоединим короткую стеклянную…
Основные понятия органической химии
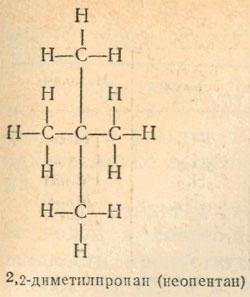
Углерод, конечно, нельзя отнести к числу наиболее распространенных химических элементов. В земной коре его всего лишь 0,12 %. Но от всех остальных элементов он отличается исключительным разнообразием химических соединений. Число известных в настоящее время соединений углерода более чем вдвое превышает количество соединений всех остальных элементов, вместе взятых. Такое своеобразие углерода объясняется особыми способностями его атомов…
Этен — ненасыщенный углеводород

В алканах все свободные валентности атомов углерода насыщены атомами водорода. Поэтому их называют еще насыщенными углеводородами. В отличие от них, ненасыщенные углеводороды содержат меньше водорода. Свободные валентности соседних атомов углерода взаимодействуют в них друг с другом и образуют двойные или тройные связи. В структурных формулах такие связи изображаются двумя или тремя черточками между соответствующими атомами…
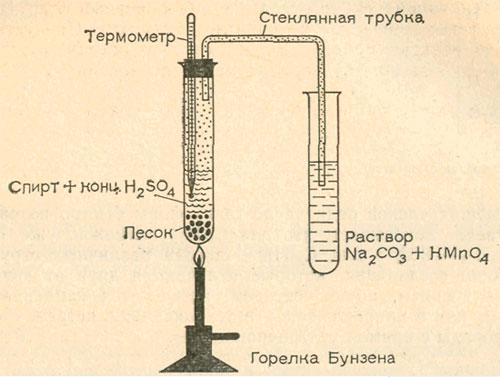
Соберем простой прибор. Для этого понадобятся две пробирки. К одной из них подберем пробку с двумя отверстиями и вставим в нее изогнутую стеклянную трубку и термометр со шкалой до 250 °С. Все соединения должны быть достаточно плотными, чтобы образующийся газ мог выходить только через трубку. В пробирку поместим 2 мл денатурированного спирта и осторожно, малыми…
Обнаружение элементов в органических веществах

Большинство органических соединений состоит преимущественно из углерода и водорода. Уже знакомые нам углеводороды содержат только эти два элемента. В остальных же органических соединениях, со многими из которых мы по¬знакомимся позже, содержатся еще один или несколько других элементов, чаще всего кислород, галогены (хлор, бром, иод), азот и сера. Приведенные ниже простые опыты во многих случаях пригодны…

Чтобы выяснить, есть ли в веществе азот, пробу греют в пробирке с избытком натронной извести. Если ее нет, можно заменить ее смесью гидроксида натрия (едкого натра) с избытком негашеной извести. Проследим только, чтобы в верхней части пробирки не осталось приставших частиц извести. Заткнем пробирку кусочком ваты, а на него положим увлажненную полоску красной лакмусовой бумаги….

Во многих случаях галогены в органических соединениях можно обнаружить с помощью пробы Бейльштейна. Возьмем не слишком тонкую медную проволоку без изоляции, зачистим се и загнем один конец петелькой. В петле укрепим кусочек пористой керамики («кипелку»). Прокалим этот конец проволоки в несветящейся зоне пламени горелки, пока не исчезнет зеленая окраска пламени. Затем погрузим петельку в исследуемую…

Для обнаружения серы обычно прокаливают пробу с металлическим натрием. При этом сера переходит в сульфид, который обнаруживают с помощью нитропруссида натрия. Мы выберем другой способ, чтобы обойтись без труднодоступного и опасного натрия. На кончике шпателя возьмем пробу исследуемого вещества и поместим ее в маленькую фарфоровую чашку. Добавим немного концентрированной или лучше дымящей азотной кислоты и…

Уголь в том состоянии, в каком он находится в природе, не годится для непосредственного использования в химической промышленности. Его нужно предварительно облагородить, превратив в как можно более чистые углерод и углеводороды. Один из самых крупных потребителей угля — металлургия. В доменных печах уголь служит одновременно топливом и восстановителем для оксидных руд. Но при использовании только…
Построим установку полукоксования
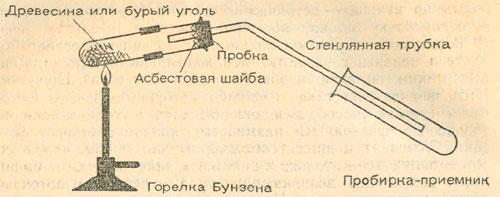
Сухую перегонку древесины и полукоксование бурого угля можно провести с очень малыми количествами веществ — даже в пробирке. Таким образом, с основами процесса можно ознакомиться при наличии хотя бы самого простого оборудования. В этом случае нам понадобится установка для перегонки. Однако, чтобы дистиллята хватило для дальнейшей работы, сосуд для перегонки должен быть не менее 1…
