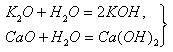
Основные оксиды. К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований. Получение основных оксидов: 1. Окисление металлов при нагревании в атмосфере кислорода: 2Mg + О2 = 2МgО, 2Сu + О2 = 2СuО. Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na2О, К2О крайне труднодоступны. 2….
Диссоциацию оснований более точно, с учетом гидратации ионов, следует писать так: КОН(к.) К+(водн.) + ОН—(водн.) NH3.H2O1 NH4+(водн.) + ОН—(водн.) 1. Это соединение часто записывают как NH4OH и называют гидроксидом аммония. Основания в воде диссоциируют на ионы металла (аммония в случае гидрата аммиака) и гидроксид—ионы. Никаких других анионов, кроме гидроксид—ионов, основания не образуют. Согласно международной номенклатуре названия оснований составляются из слова гидроксид и названия металла. Например, КаОН — гидроксид натрия, КОН — гидроксид калия, Са(ОН)2 — гидроксид кальция. Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках: Fe (ОН)2 — гидроксид железа (II), Fe(ОН)3 — гидроксид железа (III). Помимо этих названий, для некоторых наиболее важных оснований применяются и другие. Например, гидроксид натрия NaОН называют едкий натр;…

Растворы щелочей мыльные на ощупь. Изменяют окраску индикаторов: красного лакмуса — в синий цвет, бесцветного фенолфталеина — в малиновый цвет. Щелочи NaОН и КОН очень устойчивы к нагреванию. Например, NaОН кипит при температуре 1400oС без разложения. Однако большинство оснований при нагревании разлагается. Например: Cu(ОН)2 = СuО + Н2O2Fе(ОН)3 = Fе2O3 + ЗН2О Важнейшие химические свойства оснований обусловливаются их отношением к кислотам, кислотным оксидам и солям. 1. При взаимодействии оснований с кислотами в эквивалентных количествах образуются соль и вода: КОН + НСl = КСl +…

Амфотерными называются такие гидроксиды, которые при диссоциации образуют одновременно и катионы водорода Н+ и гидроксид-ионы ОН—. Такими являются Аl(ОН)3, Zn(ОН)2, Cr(ОН)3, Ве(ОН)2, Gе(ОН)2, Sn(ОН)4, Pb(ОН)2 и др. Амфотерные гидроксиды взаимодействуют как с растворами кислот, так и с растворами щелочей. Например; Аl(ОН)3 + ЗНСl = АlСl3 + ЗН2О, Аl(ОН)3 + NаОН + 2Н2О = Na[Al(OH)4(H2O)2] В настоящее время растворение амфотерных гидроксидов в щелочных растворах обычно рассматривается как процесс образования гидроксосолей (гидроксокомплексов). Экспериментально доказано существование гидроксокомплексов многих металлов: [Zn(ОН4)]2-, [Аl(ОН)4(Н2О)2]—, [Аl (ОH)6]3- и т.д. Наиболее прочны гидроксокомплексы алюминия, а из них — [Аl(ОН)4(Н2О)2]—. Такой подход не меняет сделанных выводов: у амфотерного гидроксида, например у Аl(ОН)3 и ему подобных, в кислой среде равновесие смещается в сторону образования солей алюминия, в щелочной — в сторону образования гидроксокомплексов. Очевидно, в водном растворе существует равновесие, которое более точно описывается уравнением Аl3+ + ЗОН— Аl(ОН)3 = Аl(ОН)3…
Уравнения диссоциации кислот можно записать более точно, с учетом гидратации ионов НCl(газ.) Н+ (водн.) + Cl— (водн.) СН3СООН(водн.) Н+(водн.) + CH3COO-(водн.) Как видно, кислоты в воде диссоциируют на ионы водорода и кислотные остатки — анионы. Никаких других катионов, кроме ионов водорода, кислоты не образуют. Механизм диссоциации кислот: вокруг полярных молекул ориентируются диполи воды и в…

Большинство кислородных кислот получают при взаимодействии оксидов неметаллов (в высокой степени окисления) с водой. Например: SO3 + H2O H2SO4; N2O5 + H2O = 2HNO3 Если такие оксиды нерастворимы в воде, то соответствующие им кислоты получают косвенным путем, а именно, действием другой кислоты (чаще всего серной) на соответствующую соль. Например: Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓ Бескислородные кислоты получают путем соединения водорода с неметаллом с последующим растворением водородного соединения в воде. Таковы НF, НСl, НВr, НI, H2S. Свойства. Кислоты представляют собой жидкости (Н2SO4, НNO3 и др.) или твердые вещества (Н3PO4 и др.). Многие кислоты хорошо растворимы в воде. Растворы их имеют кислый вкус, разъедают растительные и животные ткани, изменяют синий цвет лакмуса на красный. Ниже перечислены важнейшие химические свойства кислот: 1. Взаимодействие с металлами (с образованием соли и выделением водорода)….

Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на металла, в кислых солях они замещенытолько частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки. Существуют также некоторые другие типы солей, например: двойные соли, в которых содержатся два разных катиона и…

Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов (Сl, S и т.д.). Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются: СаСО3 = СаО + СО2, 2Ag2СОЗ = 4Аg + 2СО2 + О2, NН4Сl = NН3 + НСl, 2КNОЗ = 2КNО2 + О2, 2FеSО4 = Fе2О3 + SО2 + SО3, 4FеSО4 = 2Fе2ОЗ + 4SО2 + О2, 2Сu(NО3)2 = 2СuО +…
Глицерин как новое сырье для химического производства

В связи с истощением мировых запасов нефти и другого природного углеводородного сырья практически во всех индустриально развитых странах идут поиски альтернативных источников топлива для удовлетворения запросов энергетики и транспорта. В последнее время популярным стало использование биодизельного топлива, основа химического получения которого заключается в метанолизе растительных масел. Увеличение производства биодизеля приводит к образованию больших количеств сопутствующего…
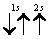
В1925 г. швейцарский физик В.Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное впоследствии принципом Паули (или запретом Паули): В атоме не может быть двух электронов, обладающих одинаковыми свойствами. Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так: В атоме не может быть двух электронов, у которых все…
